|
二维 (2D) 细胞培养模型由于其易于使用且与高通量筛选的兼容性而经常用于开发癌症治疗的药物发现。三维 (3D) 细胞培养模型,能更好地模拟体内的肿瘤微环境,以弥合体外研究与临床试验之间的差距。了解癌细胞与肿瘤微环境中其他细胞类型(如成纤维细胞、内皮细胞和免疫细胞)之间复杂的相互作用对于预测治疗效果至关重要。许多因素,如缺氧、细胞外基质和各种可溶性因子都与耐药性和致敏性有关。传统的 3D 细胞培养方法通常耗时且存在差异性,并且可能缺乏筛选所需的通量。
康宁球形微孔板采用创新的专利设计,非常适合在同一微孔板内培养和后续检测3D细胞球。超低吸附表面,帮助形成大小均一、可重复性好的3D细胞球。黑色不透明板壁将不同孔的圆形透明底相互屏蔽,避免了孔间信号的交叉干扰。
人肺癌细胞系 A549 细胞在球形板中单独培养,或和原代人肺成纤维细胞 [FB] 以及外周血单个核细胞 [PBMC]共培养。在单独培养和共培养条件下用各种化疗药物治疗后筛选肿瘤球的活力,比较所选化疗药物的剂量依赖反应,表明多种细胞类型在 3D 测定中可能影响治疗结果。

单独和共培养球体的形成
A549 细胞和正常人肺成纤维细胞(FB)以 2D 形式培养。 A549 细胞在补充有 10% 胎牛血清 (FBS)的 F-12K中培养,FB 在FGM-2(成纤维细胞培养基)中培养。收获细胞并接种到 384 孔球形微孔板(康宁目录号 3830)中,每孔含 2,000 个细胞,加入 20 μL FB 培养基。对于共培养,细胞比例因最佳培养条件而异。对于化疗剂量反应测定,A549 细胞和 FB 在单独培养条件下以每孔 2,000 个细胞接种,共培养条件下FB 与 A549 细胞的比例为 9:1。球形板用透气膜密封,130 x g 离心后在 37°C、5% CO2培养箱中培养48 小时。对于三细胞共培养条件,将 PBMC融化到含有 10% FBS 的 IMDM中,以 200 x g 离心 15 分钟,然后用FB 培养基重悬。将 PBMC 加入到已经含48 小时单独培养和共培养 A549 和 FB 球体 的384 孔球形微孔板中,每孔加入1800 个细胞及 10 μL FB 培养基。作为没有 PBMC 的单独和共培养条件的对照,每孔添加 10 μL FB 培养基。将球体再培养 48 小时然后进行固定或染色。
共培养球体染色/成像
吸出培养基并将球体在每孔 30 μL 的 4% 多聚甲醛中室温固定,然后在 4°C 保存。
对于免疫组织化学 (IHC),固定的细胞包埋后在冷冻切片机中切片为 10 μm 厚度。对细胞进行 DAPI 、CK7和成纤维细胞活化蛋白的染色。
对于活细胞和死细胞染色,如前所述,将 A549 和 FB 接种在单独和共培养条件下。培养 48 小时后,每孔加入 10 μL FB 培养基,然后以剂量依赖性方式每孔加入 10 μL 阿霉素。 1X 最高剂量为 862 μM,随后在含有 10% 二甲基亚砜 (DMSO)的 FB 培养基中进行 1:5 稀释。对于对照孔,加入 10 μL 含 10% DMSO 的 FB 培养基。细胞球在处理后再孵育 48 小时。总共培养 96 小时后,使用LIVE/DEAD™ 细胞活力/细胞毒性试剂盒对细胞进行染色。使用 EVOS® 荧光显微镜在 10X 物镜下成像。
化疗筛查
为了确定最佳接种条件,使用了化合物阿霉素和紫杉醇。用于化疗测试的化合物列于表 1。在加入培养基或 PBMC 后,加入10 μL/孔的化合物。对照加入 10 μL 含有 10% DMSO 的 FB 培养基。在细胞活力测定之前,将细胞球再培养 48 小时。对于每种化合物,此操作在两次独立的时间重复三次。
使用 CellTiter-Glo® 3D测定球体的细胞活力。在加入化合物 48 小时后,在球形微孔板中每孔加入40 μL CellTiter-Glo 3D 试剂。将微孔板摇动 5 分钟,然后室温下孵育25分钟。使用 Tecan Infinite® M1000 读板机测量发光。通过与对照孔比较发光,测量的一半细胞不再存活的浓度计算为每种化合物的毒力(TC50)。
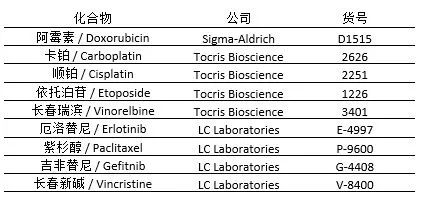
表1:用于化疗筛选的化合物
形成单独培养、共培养和三培养细胞球
通过在球形微孔板中培养细胞总共 96 小时形成单独培养、共培养和三培养的球体,在 48 小时加入 PBMC 以形成三种细胞共同培养的细胞球。对于所有培养条件,在每个孔中都形成了可重复的单个球体。 如免疫组织化学结果所示,三种球体类型均显示高水平的A549 细胞表达的细胞角蛋白 7 (Cyk7) 染色(绿色),并且共培养和三培养球体也显示成纤维细胞活化蛋白 (FAP) 染色 (红色),表明共培养和三培养球体中FB的存在(图 1)。值得注意的是,通过 IHC 染色可以看到作为悬浮细胞的 PBMC的存在影响 了细胞球中FAP 的表达。
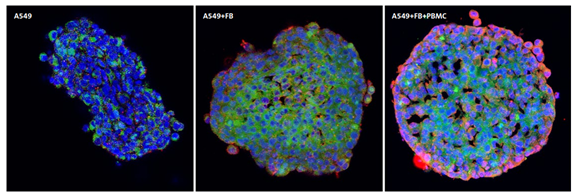
图1:单独培养、共培养和三培养细胞球的免疫组织化学结果。 A549 细胞以 750 个细胞/孔接种; A549 和成纤维细胞 [A549+FB] 以 1:1 的比例以 2K 细胞/孔接种; A549、成纤维细胞和外周血单核细胞 [A549+FB+PBMC] 以 2:1:1 的比例以 2K 细胞/孔接种。 细胞在球形微孔板中培养 96 小时,然后在 4% PFA 中固定。 细胞球用 DAPI(蓝色)、抗 Cyk7(绿色)和抗 FAP(红色)染色。
A549 细胞和 FB 能够以不同的比例加入共培养球体中。为了确定化疗筛选的最佳细胞接种比例,使用 9:1、8:2 和 1:1 的 FB 与 A549 细胞比例形成共培养球体。培养 48 小时后,加入一系列剂量的化疗药物阿霉素和紫杉醇,并将球体再培养 48 小时。每个单一和共培养条件都使每孔生成一个细胞球(图 2)。总共培养 96 小时后,使用 CellTiter-Glo 3D 细胞活力测定法评估细胞活力。如图 3 所示,FB 单一培养细胞球在暴露于低剂量阿霉素 48 小时后表现出比 A549 单一培养球体更高的细胞活力。 FB 与 A549 细胞 9:1 的比例也显示了 FB 对低剂量阿霉素处理的保护作用。与 A549 单培养细胞球相比,FB 单培养细胞球在高剂量和低剂量下也显示出对紫杉醇的抗性,但是 FB 的存在并未显示对 A549 细胞的保护作用。在低剂量阿霉素的处理下,FB 对 A549 细胞的保护作用也可以使用活力和细胞毒性染色观察到(图 4)。
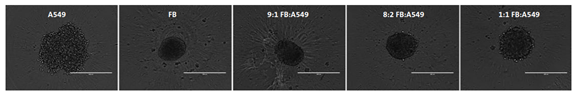
图2:康宁 384 孔球形微孔板中单独培养和共培养 A549 和肺成纤维细胞的 48 小时图像。将细胞以总数2K 细胞/孔接种,单独培养以及成纤维细胞 (FB) 与A549 细胞的共培养比例为 9:1、8:2 和 1:1。使用 EVOS 荧光显微镜在 10X 物镜下拍摄的图像。 Scale bar = 400 μm。
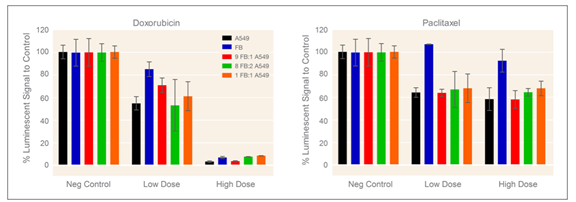
图3:A549 对化疗药物的敏感性受肺成纤维细胞存在的影响。 48 小时单独培养和共培养 A549 和肺成纤维细胞 (FB) 细胞球暴露于阿霉素(高剂量 = 862 μM,低剂量 = 1.3 μM)和紫杉醇(高剂量 = 1.2 μM,低剂量 = 9 nM) 48小时。
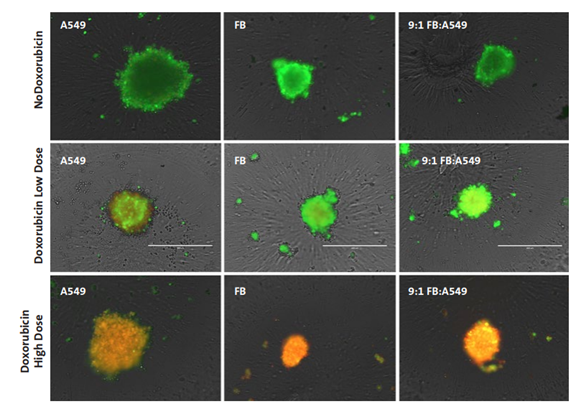
图4:活(绿色)和死(红色)染色 96 小时单独培养和共培养 A549 和成纤维细胞球。 在康宁 384 孔球形微孔板中,球体暴露于高 (34.5 μM)和低 (27.6 μM) 剂量的阿霉素或对照中48 小时。 成纤维细胞 (FB) 单一培养在低剂量阿霉素下显示出最强烈的活染色,而 A549 单一培养显示细胞死亡增加。 FB 与 A549 细胞 9:1 的比例在低剂量阿霉素暴露下也显示出保护作用。 所有细胞类型在高剂量暴露后都表现出显著的毒性。 图像使用 EVOS 荧光显微镜在 10X 物镜下拍摄。 Scale bar = 400 μm。
单独培养、共培养和三培养球体的化疗筛选
在球形微孔板中培养 48 小时后,将几种化疗化合物以不同剂量处理单独培养、共培养和三培养细胞球。使用 CellTiter-Glo 3D 细胞活力测定评估细胞活力,以生成剂量反应曲线(图 5)。不同球体培养条件下的毒性效力 (TC50) 值进行比较发现(表 3),尽管 FB 和免疫细胞的存在不影响化合物卡铂和顺铂对 A549 肺肿瘤细胞的效力,但其他几种化合物的效力右移,表明其他细胞类型如FB在共培养细胞球中的存在有保护作用 。
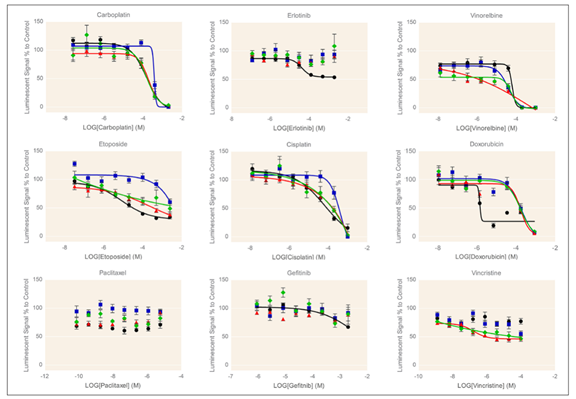
图5:化合物处理单独培养、共培养和三培养球体的剂量效应曲线。 成纤维细胞 (FB) 和免疫细胞的存在影响了几种化合物的效力。 黑色 = A549,蓝色 = FB,红色 = A549 + FB,绿色 = A549 + FB + PBMC。
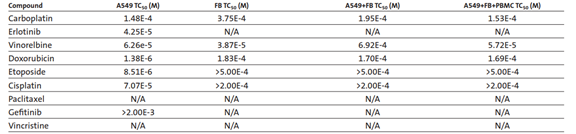
表2:应用于单独培养、共培养和三培养球体的化合物的毒性效力 (TC50) 值
●康宁球形微孔板可用于生成单独培养和共培养细胞球,并以易于使用的高通量形式进行活力测定。
●在康宁球形微孔板中形成的细胞球可以进行免疫组织化学和荧光染色分析。
●球体中其他原代细胞的存在可能会影响化合物的效力。
| 










